Elemento químico
Um elemento é a substância química simples que consiste de átomos de um só tipo e não pode ser dividida por meios químicos em uma substância mais simples. Por exemplo, ouro, oxigênio e carbono são todos elementos. O número de prótons no núcleo de um átomo determina a identidade de um elemento. Por exemplo, átomos que tem um próton são hidrogênio e átomos que tem oito prótons são oxigênio.
Átomos são as menores partes de um elemento químico que ainda têm as propriedades desse elemento. Elementos portanto, são identificados pelas propriedades dos seus átomos e, em particular, o número de prótons no núcleo. Todos os átomos de hidrogênio tem um próton, todos os átomos de carbono têm seis, todos átomos de oxigênio tem oito, etc
Elementos comuns
Carbono, hidrogênio, nitrogênio e oxigênio são freqüentemente encontrados na natureza. O carbono é essencial para todos os organismos vivos e é adicionalmente encontrado em muitos elementos da natureza, bem como em produtos sintéticos. [1] O hidrogênio é um elemento gasoso encontrado em grande abundância em todo o universo. A forma mais comum de hidrogênio na Terra é em seu composto com oxigênio, a água. Também é utilizado pelo homem para propósitos metálicos e orientados a armas. [2] O nitrogênio constitui a maioria do ar da Terra, mas também é utilizado para a fabricação de pelo homem fertilizantes, venenos, e explosivos. [3] O oxigênio é um elemento essencial, especialmente na terra compondo o ozônio. O ozônio protege a Terra e seus habitantes dos raios ultravioleta do Sol.[4] Estes quatro elementos abundantes na natureza, funcionam em conjunto para formar um grande número de compostos orgânicos e inorgânicos.
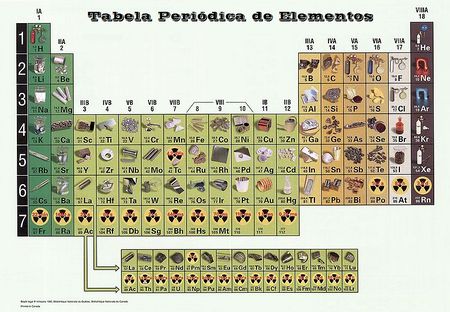
Tabela periódica
Elementos are arranged into a table (são organizados em uma tabela (chamado de Tabela Periódica dos Elementos) baseada em propriedades que elementos diferentes compartilham em comum - propriedades que foram reconhecidas de repetir periodicamente quando os elementos de crescentes massas atômicas foram comparados.
Cada célula da tabela contém um elemento diferente. As células da maioria das tabelas periódicas contém o nome e o símbolo de cada elemento, o número atômico (o número de prótons), e a massa atômica (média do número de prótons mais nêutrons). Algumas tabelas periódicas irão conter outras informações, tais como a configuração da camada de elétrons de cada elemento, ou seu estado à temperatura ambiente (líquido, gás, ou sólido).
As configurações de elétrons dos átomos determina principalmente a sua reatividade química, e particularmente os dos elétrons da camada externa (ou "valência"). Os elementos da tabela periódica são dispostos em linhas (conhecidos como grupos ou famílias), e colunas (conhecidos como períodos) com base em quantas camadas de elétrons um átomo possui e o número de elétrons na camada externa, respectivamente.

Símbolo químico
Cada elemento tem o seu próprio símbolo químico ou símbolo atômico para identificá-lo. Hoje a maioria dos símbolos químicos derivam dos nomes ingleses modernos dos elementos que eles representam. No entanto, o metais da antiguidade retém os símbolos derivados de seus nomes em latim ou grego originais, por exemplo, nátrio (sódio), kalium (potássio), hydrargyrum (mercúrio), etc
Número atômico
O número de prótons que um elemento tem é chamado de número atômico. Todos os átomos do mesmo elemento têm o mesmo número atómico. O número atómico dos vários elementos podem normalmente ser encontrados acima do símbolo químico do elemento na Tabela Periódica dos Elementos.
Massa atômica
O número total de prótons e nêutrons que qualquer átomo dado tem é o seu número de massa atômica. No entanto, a maioria das entradas na tabela periódica identifica a massa atômica de cada elemento. Este número é a média ponderada dos números de massa atómica das várias formas (isótopos) desse átomo que são encontrados na natureza.
Isótopos
Átomos do mesmo elemento que têm números diferentes de nêutrons são chamados isótopos. Cada elemento que é encontrado na natureza (isto é, não é um elemento sintético) existe normalmente como vários isótopos, em proporções variáveis. Assim, para calcular a massa atómica, se calcula uma média ponderada dos números das massas atômicas de todos os isótopos, utilizando-se como peso as proporções dos isótopos que existem normalmente na natureza.
Duas exceções a esta regra existem:
1. Um isótopo sintético nunca tem uma parte no cálculo da massa média ponderada atômica.
2. A massa atómica de um elemento totalmente sintético, tal como o tecnécio, é o número de massa atómica do isótopo mais comumente sintetizado ou de um primeiro isótopo relatado.
Uma vez que os isótopos têm apenas um número diferente de nêutrons, eles têm as mesmas propriedades elétricas (ligação), mas frequentemente têm diferentes propriedades físicas, tais como a meia-vida. Muitas técnicas de datação envolvem a medição de quantidades de isótopos em uma amostra. (Ver datação radiométrica) Além disso, pode-se separar os isótopos do mesmo elemento, usando uma centrífuga de gás. Esta técnica produz misturas de isótopos que são significativamente diferentes da mistura natural. A aplicação mais comum desta técnica é o enriquecimento de um elemento radioativo, como urânio, para produzir combustível para um reator nuclear, ou para a construção de armas nucleares.
Elementos sintéticos
Um elemento sintético é qualquer elemento químico, que não é encontrado na natureza e existe apenas em laboratórios. Elementos sintéticos vêm da fusão controlada de átomos mais leves, usando qualquer um dos diversos instrumentos de aceleração de partículas (linac, ciclotron, etc.) para acelerar átomos e fazer com que colidam uns com os outros. A síntese de novos elementos é feita por dois motivos:
1. Para mostrar que certos elementos que estão "faltando" da tabela periódica tem, de fato, as propriedades que a periodicidade de todos os elementos químicos poderiam prever que eles teriam.
2. Para produzir novos elementos, a fim de estudar o tipo, a qualidade e quantidade de partículas que podem emitir.
A lista de elementos sintéticos inclui o tecnécio, promécio, plutônio, e cada elemento tendo uma número atómico mais elevado do que o do plutónio.
Todos os elementos sintéticos, sem exceção, são radioativos. A maioria deles tem meias-vidas muito curtas.
Elementos
Referências
| ||||||||||||||