Sulfato
| Sulfato | |
|---|---|
| |
| Geral | |
| Nome sistemático | Sal de ácido sulfúrico |
| Outros nomes | Sulfeto de hidrogênio |
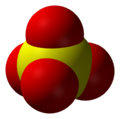
| Fórmula molecular | SO42− |
| SMILES | O=S |
| Massa molar | Massa molar::96.06 g/mol |
| Aparência | Precipitado branco |
| Número CAS | Número CAS::Não disponível |
| Propriedades | |
| Solubilidade em água | 250mg/l |
| Ponto de fusão | Ponto de fusão::3°C |
| Ponto de ebulição | Ponto de ebulição::290°C |
| Estrutura | |
| Forma molecular | Arranjo tetraédrico |
| Riscos | |
| MSDS | Ficha de segurança |
| Principais riscos | Ingestão |
| Compostos relacionados | |
| oxiânions sulfurados relacionados | Peróximonosulfato Sulfito Pirossulfato Ditionato Metabissulfito Ditionito Tiossulfato Tetrationato |
| Compostos relacionados | sulfato de cálcio sulfato de estrôncio sulfato de chumbo (II) sulfato de bário |
| Exceto quando indicado o contrário, os dados são fornecidos para materiais no seu estado padrão (a 25 °C, 100 kPa) Aviso legal e referências | |
O sulfato é um ânion inorgânico poliatômico composto de enxofre e oxigénio. Ele tem uma fórmula empírica SO42− e forma sais com muitos metais. Ocorre naturalmente na água de beber e questões de saúde quanto à sua ingestão são agora uma preocupação da Agência de Proteção Ambiental dos EUA.[1]
Propriedades
O sulfato é um sal de ácido sulfúrico. A maioria é altamente solúvel em água. Por exemplo: sulfato de clácio, sulfato de estrôncio, sulfato de chumbo(II), sulfato de bário e sulfato de rádio. O sulfato funciona em base conjugada, então pode estar junto com outros elementos ou compostos. Porém, estes compostos não são sempre perfeitamente solúveis em água; alguns compostos têm baixa solubilidade na água. Por exemplo: sulfato de cálcio, sulfato de estrôncio, sultao de chumbo (II), e sulfato de bário. Por outro lado, o sulfato de rádio é o melhor exemplo de sulfato solúvel na água. O sulfato está na lista dos oxiânions do enxofre.
Lista de oxiânions do enxofre = sulfato, peroximonosulfato, sulfito, pirossulfato, metabissulfito, ditionato, ditionito, tiossulfato, e tetrationato. [2]
Ocorrências

Sobretudo, o sulfato é encontrado em águas naturais (águas subterrâneas), porque a água natural contém elevada percentagem de sulfato. Na água, podemos obter sulfato através de três formas, que são a osmose inversa, a destilação e a troca iônica. O modo da osmose inversa é usar um sistema de tratamento, e então ejetar a maioria dos elementos que são sulfato e outros. A forma de destilação também usa o sistema de tratamento de água, e em seguida, água fervida sendo removida sem o sulfato e outros, de modo que sulfato permanece na panela. A última maneira é troca iônica, que consiste em retirar quantidades de sulfato da água. Mas não se utiliza em casa, ela só funciona para trabalho químico.[3] Em outros compostos, também podemos encontrar sulfato. O sulfato de magnésio (MgSO4), o sulfato de cálcio (CaSO4), sulfato de bário (BaSO4), e sulfato de estrôncio (SrSO4), estes quatro compostos, contém sulfato. Assim, podemos separar o sulfato dos outros elementos. Por exemplo, o sulfato de cálcio quando vem no estado natural, podemos separar o sulfato do cálcio. Também o sulfato de bário pode ser separado em sulfato e bário.[4]
Usos
O sulfato é usado em muitas partes da nossa vida, como a bateria de chumbo-ácido, sulfatados utilizados através de ácido sulfúrico para eletrólitos entre o chumbo metálico (Pb) e chumbo (IV) dióxido (PbO2). Em microrganismos, sulfatados são usados para receptores de elétrons. Bem conhecido, os sais de Epsom também usam sulfato, desta vez, o sulfato misturado com magnésio, formando, sulfato de magnésio, que é usado principalmente para laxante salino [5]. Além disso, o sulfato de morfina é usado em medicina para doentes. No hospital, o sulfato de morfina é usado para controlar a dor. Ele pode controlar a dor a curto prazo e a dor a longo prazo. Além disso a morfina pode ser usada como anestesia em cirurgias de íon e controle da respiração difícil. Ela pode ajudar pessoas morrendo, porque pode fazer o corpo da pessoa ficar relaxado. No entanto, às vezes, é usada como drogas, algum viciado em drogas vêm ao hospital para tomar morfina sem dor.[6] O sulfato de amónio é utilizado para fertilizantes para solos alcalinos. Ele tem menor nível de PH, por isso, se ele for colocado em solos alcalinos, pode fazer o equilíbrio do pH estar nos níveis naturais. Também é usado como apoio em herbicidas e inseticidas nas partes agrícolas. O sulfato de alumínio é utilizado para a limpeza da água. Na água, ele funciona para fazer congelação de impurezas e limpar as partes inferiores do tanque de água.
Acidentes e primeiros socorros
A água natural contém altas concentrações de sulfatos, de forma que precisamos tomar cuidados com a ingestão e inalação. Em 1993, A Organização Mundial de Saúde modificou os limites para a ingestão de sulfato - era de 500mg por litro, mas após 1998, mudou para 250mg por litro. O sulfato não é perigoso, mas se as crianças ingerirem sulfato em excesso, ele pode causar diarréia e morte. Se você ingerir mais de 500mg de sulfato, deverá beber água para diluir o sulfato, e tomar remédios. Se o sulfato entrar em contato com a pele e houver irritação, deve lavar a pele com sabão e água e tomar medicação. Se o sulfato entrar em contato com os olhos, estes podem ficar vermelhos; se isto ocorrer, deve lavar os olhos com água corrente por pelo menos 15 minutos. Se o problema não melhorar, ou se agravar, deve receber cuidados médicos de um oftalmologista. [7]
Referências
- Sulfate Wikipedia.org, Wikimedia Foundation, Inc
- Sulfates lenntech, water treatment and purification unknown author.
- The Sulfates Class Mineral Gallery unknown author.
- Sulfuric Acid MSDS, Environmental Health & Safety, .
- History of sulfate SAO/NASA
- Magnesium sulfate wikipedia.org, wikimedia foundation, Inc
- Morphine sulfate university of maryland medical center unknown author.
| ||||||||||||||

