Isótopo
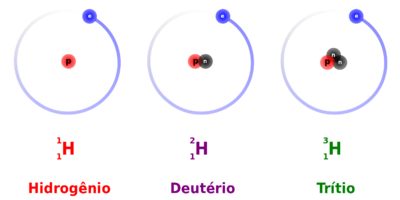
Isótopos são um de dois ou mais átomos do mesmo elemento com o mesmo número de prótons (número atômico), mas com diferentes números de nêutrons, resultando em um número de massa atômica diferente.[1]
Eles são variações de elementos químicos, como carbono-12 versus carbono 14. Embora cada elemento tenha o mesmo número de prótons (número atômico), eles podem ter diferentes números de nêutrons e, portanto, diferentes números de massa atômica. Isótopos de qualquer elemento particular podem ter propriedades diferentes, e serem mais ou menos estáveis do que os outros.
Massa atômica
A massa atômica de um elemento é a massa média dos isótopos deste elemento.[2]. A massa atômica de qualquer átomo específico (ou isótopo) é uma combinação do número de prótons mais o número de nêutrons que possui. Por exemplo, o carbono sempre tem 6 prótons e, normalmente, também tem 6 nêutrons, mas alguns carbonos tem 7 nêutrons, e uma pequena quantidade de carbono pode ser encontrado com 8 nêutrons. Estas variações de átomos de carbono são o que são conhecidos como isótopos.
A massa atômica e assim o isótopo de um elemento particular é abreviado com um sobrescrito acima do símbolo elementar, tal como 12C, 13C, e 14C. Alternativamente, o isótopo pode ser escrito de uma forma com hífen, como carbono-12 ou C-12.
A massa atômica listada para cada elemento da Tabela Periódica dos Elementos é a massa atômica média dos diferentes isótopos encontrados na natureza.
| Isótopo | Massa atômica |
|---|---|
| Carbono-12 | 6 Prótons + 6 Nêutrons |
| Carbon-13 | 6 Prótons + 7 Nêutrons |
| Carbon-14 | 6 Prótons + 8 Nêutrons |
Isótopos como o carbono-14 são utilizados em procedimentos de datação radiométrica, em uma tentativa de atribuir datas para artefatos e rochas.
Referências
Ligações externas
- Isotopes University of Colorado
| ||||||||||||||