Íon
Um íon é uma partícula química carregando uma carga elétrica. Íons têm tanto um excesso ou um déficit de elétrons em comparação com o número total de prótons nos núcleos dos seus átomos constituintes - e é por isso que têm uma carga líquida.
Formação
Um átomo sem carga tem tantos elétrons, quanto prótons. No entanto, a menos que esse átomo seja um membro do grupo dos gases nobres na tabela periódica, tal átomo terá um invólucro exterior incompleto de elétrons. Esta é uma situação inerentemente instável, e um átomo neste estado vai tentar ajustar a sua configuração eletrônica para corresponder ao do átomo do gás nobre mais próximo. Para isso, um átomo pode:
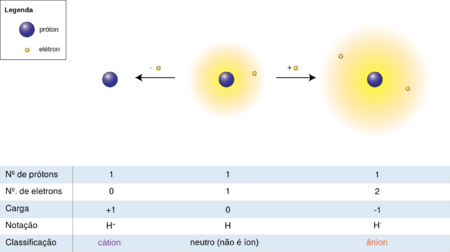
- 1. Lançar elétrons de sua camada externa até a sua configuração corresponder à do gás nobre que termina o período imediatamente acima do seu próprio período. Assim, o sódio, tendo um elétron em sua camada externa, irá lançar esse elétron e, portanto, irá ter dez elétrons dispostos na configuração estável de um átomo de neon. Um átomo de sódio em tal estado é um íon de sódio, tendo uma carga de +1.
- 2. Adquirir elétrons para preencher sua camada externa, de modo que a sua configuração irá coincidir com a do gás nobre no final do seu próprio período. Assim, o flúor irá adquirir um único elétron, a fim de coincidir com a configuração eletrônica do neon. Esse átomo de flúor será agora um íon fluoreto tendo uma carga de -1.
- 3. Formar um ligação covalente com outro átomo, em que cada átomo contribui com um, dois, ou mesmo três elétrons que passam cada parte do seu tempo associados a cada átomo de modo a completar as camadas de elétrons de ambos os átomos
Isso não se aplica, no entanto, aos metais em sua forma "metálica" usual. O que nós pensamos como um metal, é um elemento metálico em forma cristal metálica, que tem átomos desse metal "nadando" em um "mar" de elétrons.
Valência
Todos os íons têm carga, e estas podem ser positivas ou negativas. A quantidade ea direção da carga é a valência do íon. Um íon tendo uma valência positiva é chamado cátion (a partir do grego kata para baixo), e um íon com uma valência negativa é denominado ânion (a partir do grego ana para cima).
Tipos de íons
Além da valência, se descreve íons pelo número de átomos que contêm, de acordo com algumas convenções de nomenclatura altamente específicos.
Monoatômico
Íons simples, ou íons monoatômicos (a partir do grego monos sozinho), existem como átomos individuais que tenham adaptado o seu número de elétrons para uma configuração estável, perdendo ou adquirindo elétrons. O símbolo de um cátion simples é o símbolo do seu elemento químico base com um ou mais sobrescritos "+" sinais aplicados a ele para indicar sua carga.
Cátions simples são formalmente chamados por seus nomes de elementos com um numeral romano sufixado entre parênteses para indicar sua carga--deste modo, sódio (I) ou ferro (II) ou ferro (III). Usualmente um cátion simples com carga +1 é chamado apenas pelo seu nome do elemento, particularmente no caso dos cátions formados a partir de elementos do Grupo IA. Os cátions também podem ter nomes informais, formados pela adição do sufixo -ico ao seu nome (geralmente o seu nome desde a antiguidade) para um cátion com a carga mais comum, ou -oso se o cátion tem menos do que a carga habitual--deste modo, ferroso para o ferro (II) ou férrico para o ferro (III), porque o ferro (III) é um íon mais comum do que o ferro (II).
Um simples ânion tem um nome que é o nome elementar original com a sílaba final alterada para -eto. Assim, o ânion do flúor é chamado fluoreto, o do cloro, cloreto, e assim por diante. O seu símbolo é o símbolo químico do seu elemento de base com um sinal de hífen ou sobrescrito "-" com um multiplicador prefixado para ele (Se a carga é maior do que -1), ou às vezes uma pilha sobrescrita de hífens.
O principal determinante da valência é o grupo no qual o elemento de base do íon está. Group IA atoms form +1 cations, and group IIA atoms form +2 cations. Do mesmo modo, os átomos do grupo VIIA formam ânions -1, e átomos do grupo VIA formam ânions -2. No entanto, os átomos do grupo B, especialmente os metais, podem formar uma grande variedade de íons de valências, geralmente positivas.
Átomos de gases nobres nunca formam íons, exceto sob as condições mais extremas de laboratório produzidas.
Poliatômicos
Quando dois ou mais átomos se unem por ligações covalentes, e ainda têm uma carga líquida na totalidade da partícula para corrigir um desequilíbrio em suas configurações eletrônicas, o resultado é um íon poliatômico. A maioria dos íons poliatômicos são ânions, mas existem cátions poliatômicos. O mais comum destes é o amônio, que se forma quando uma molécula de amoníaco capta um próton disperso a partir de uma fonte externa, normalmente uma molécula de água em que pode estar dissolvido.
Íons poliatômicos ter uma convenção de nomenclatura estrita própria. Cátions poliatômicos comuns têm nomes que terminam em -io. Os dois catiões poliatômicos mais comuns são de amônio (NH3+) e hidrônio (H3O+). Esse último requer maiores explicações, que irão ser apresentadas a seguir.
Aniões inorgânicos poliatómicos são geralmente formadas a partir de um átomo do Grupo VIIA (halogênio), VIA, ou VA e um ou mais átomos de oxigênio, com elétrons adicionados para completar suas camadas eletrônicas. Tal ânion tem um nome formado, iniciando com o nome (ou parte do nome) do átomo principal diferencial (por exemplo, enxofre e adicionando um sufixo para indicar a carga. Os sufixos comuns para ânions inorgânicos poliatômicos são estes:
- -ato indica a forma mais comum do ânion--deste modo, SO42- é denominado sulfato.
- -ito indica um ânion tendo um a menos do que o número habitual de átomos de oxigênio--deste modo, SO32- é denominado sulfito.
- Um ânion tendo dois átomos menos de oxigênio seria nomeado pela adição do prefixo hipo- ao nome -ito. Um ânion tendo um átomo a mais de oxigênio do que a forma -ato seria nomeado pela adição do prefixo per- ao nome. Por conseguinte ClO- é chamado hipoclorito e ClO4- é chamado perclorato.
Estes sufixos não conotam nada sobre a quantidade de carga do ânion. No caso dos íons inorgânicos poliatômicos, o único fator determinante da carga é a posição do átomo distintivo na tabela periódica. Um íon poliatômico terá uma valência comparável à valência que o simples íon de um átomo distintivo normalmente têm.
Íons poliatômicos orgânicos são quase sempre as formas dissociadas de ácidos orgânicos fracos. Todos esses íons terminam no sufixo -ato- - assim, acetato, propionato,butirato , etc
Independentemente do tipo, os íons poliatômicos são simbolizados de uma maneira semelhante à das moléculas: se escreve os símbolos dos elementos constituintes, com índices para descrever a relação, e sinais de valência sobrescritos, tal como descrito acima para íons simples.
Hidrônio e hidróxido
O íon hidrônio é um caso especial que ocorre quase que exclusivamente em soluções aquosas. Contrariamente à percepção popular, os átomos livres de hidrogênio nunca formam íons dispersos em solução. Um íon de hidrogênio é o mesmo que um próton livre, deutério, ou trítio. Mas, na realidade, um dos íons de hidrogénio dissolvido em água sempre forma uma ligação covalente com um dos dois pares de elétrons no átomo de oxigênio da molécula de água mais próxima. O resultado é uma partícula tendo uma valência +1 e que consiste em três partes de hidrogênio para uma de oxigênio. Tal partícula é um íon hidrônio.
Um íon hidróxido forma quando uma molécula de água perde um de seus dois átomos de hidrogênio (quase sempre a uma outra molécula de água para formar um íon hidrônio) e retém dois elétrons extras para completar a configuração eletrônica do átomo de oxigênio. Tem uma parte de hidrogênio, uma de oxigênio, e uma valência de -1.
Composto iônico
Quando os íons não são dissolvidos em algo (ou quando o solvente é removido por evaporação), eles formam cristais que têm combinações de cátions e ânions numa proporção tal que as suas valências anular um ao outro. Os tais compostos mais comuns são binários e consistem de um de cada cátion e ânion, numa proporção que vai resultar em uma rede cristalina não tendo qualquer carga líquida. Tipicamente, dois íons tendo valências iguais e opostas se combinam numa proporção de um-para-um--ou então, por exemplo, um cátion +3 (como o ferro (III)) irá combinar com um ânion -2 (tal como um óxido) numa proporção que vai cancelar todas as cargas. Neste caso, o composto resultante, óxido férrico, iria ter a fórmula Fe2O3. (Ver composto químico para uma discussão detalhada sobre a convenção de fórmula, e da definição e uso do termo fórmula da massa.)
Compostos iônicos são nomeados pela combinação do nome de cátions com o nome de ânion--assim óxido de ferro (FeO) ou carbonato de sódio (Na2CO3).
A formação de ácidos e álcalis
Quando um composto iónico que possua hidrogênio como o único cátion é precipitado para fora da solução, os átomos de hidrogénio se ligam covalentemente ao ânion, formando um ácido. Tal composto quase sempre tem a palavra "ácido" em seu nome. A palavra depois da palavra ácido é formada por esta convenção:
- Se o ânion tinha o sufixo -ato, então modifica-se o sufixo -ato para -ico e acrescenta a palavra ácido no início. Assim, H2SO4 é denominado ácido sulfúrico.
- Se o ânion tem o sufixo -ito, então modifica-se o sufixo -ito para -oso e acrescenta a palavra ácido.
- Para anions haleto, o nome é formado mudando-se o sufixo -eto para -ico, e acrescentando a palavra ácido. Assim, o HCl é denominado ácido clorídrico.
This does not apply to Group VIA or VA compounds--and in fact, "hydrogen oxide," or water, is not an acid at all.
When an ionic compound having hydroxide as the sole anion is precipitated out of solution, the cations involved bind to the hydroxide ions and form strong bases. The most common examples are the hydroxides of sodium and potassium (commonly called caustic soda and caustic potash).
Ternary and Higher Ionic Compounds
Sometimes, three or more simple ions and/or polyatomic ions will form a compound. This usually happens when a polyvalent (having a valence with an absolute value greater than one) anion forms a compound with more than one cation of lesser valence. The formal name for such a compound begins with the names of the cations and ends with the name(s) of the anion(s). But some informal naming conventions apply. The most common example of this involves hydrogen participating as one of two or more monovalent (having a valence whose absolute value is equal to one) cations combining with a polyvalent anion. In such a case, the hydrogen ion will unite covalently with the anion, leaving the other cation to form part of a regular binary lattice. The anion thus formed will now have a lesser valence, and usually will have a different name as a result. The most common alteration is to add one atom of hydrogen to the anion--in which case the prefix bi- is added to the anion name. Examples include sodium bicarbonate (NaHCO3, "bicarbonate of soda") and sodium bisulfate (NaHSO4).
| ||||||||||||||